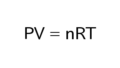化学反応に伴って出入りする熱は物質ではなくエネルギー。
燃素(フロギストン)は質量保存の法則によって、
質量0の物質・熱素(カロリック)はエネルギー保存の法則によって、
過去のモノとなった。
18世紀後半、産業革命。ワットの蒸気機関が実用化、熱効率(エネルギー効率)向上。
ただし、熱が熱素(カロリック)ではなくエネルギーであると明確になったのは19世紀前半。
蒸気機関(熱機関)を“理論的に”考察した最初の人・カルノーも物質かエネルギーか決めかねていた。
ジュールが羽根車で水を攪拌させて、その仕事(力学的エネルギー)が熱に変換されることを証明、発生した熱量(熱エネルギー)を測定した。
現在、
1[cal] = 4.186[J]
カロリー [cal]もジュール [J]もエネルギーの単位
1[cal]は純水1[g]の温度を1[K(ケルビン)]上げるのに必要な熱量(熱エネルギー)
電力の単位として使われているワット [W]は仕事率の単位。
1[W] = 1[J/s]
馬力も仕事率の単位。
電力量の単位として使われているワット時 [Wh]、キロワット時 [kWh]は仕事、エネルギーの単位。
1[Wh] = 1[W] × 3600[s] = 3600[J]
1[kWh] = 1000[W] × 3600[s] = 3.6×106[J]
エネルギー Energy
前回とりあげた理想気体の状態方程式 PV = nRTの左辺PV(圧力×体積)は、
[N/m2]・[m3]= [N(ニュートン)・m(メートル)]= [J(ジュール)]
なので、エネルギーの次元。
※ P = F/S
PV = F・x ・・・ 仕事 W(力学的エネルギー)
PVがエネルギーの次元ならば、右辺nRT(物質量×気体定数×温度)もエネルギーの次元になるが、
Rは定数なので、ほとんど温度 Tの式。
気体の場合、分子個々の運動について考えるのは現実的ではないが、1つの集まりと捉えて全体のエネルギー = 内部エネルギー Uという量で表すことができる。
理想気体の場合、内部エネルギー Uは温度 Tのみの関数になる。
気体分子運動論
単原子分子の場合、U = (3/2)nRT
なお、熱エネルギー Qと温度 Tの関係は、
Q = CT
C:熱容量
熱容量 大 ・・・ 温度変化しにくい
エネルギー保存則
化学のはずが、だんだん物理になっていく。熱化学~熱力学。
力学的エネルギー保存則は、
位置エネルギー + 運動エネルギー = 一定
位置エネルギー
mg・h
mg:重力 [N]
h:高さ [m]
運動エネルギー
(1/2)mv2
m:質量 [g]
v:速度 [m/s]
1[N] = 1[kg・m/s2]
保存(一定)なので、位置エネルギーが減少すれば、その分、運動エネルギーが増大。
摩擦、空気抵抗を無視した時、保存されるが、
実際は摩擦、空気抵抗によって力学的エネルギー減少。熱エネルギーへ変換。
熱エネルギーも考慮すれば、全体のエネルギーは保存される。
熱力学第1法則はエネルギー保存則。
Q = W + U
Q:熱エネルギー
W:外部へ働く仕事 = PV
U:内部エネルギー
外部から加えられる仕事 W’(>0)の場合(W’=-W)、
Q + W’ = U