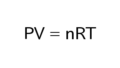mol
モル molという単位について。
molecule(分子)由来の名。
化学でたびたび出てくる基本単位。
定義を読んでも?になってしまうかもしれないが、
炭素原子(C)6.022×1023個で12[g(グラム)]、これが1[mol]。
12という値は原子量。炭素 Cは12Cと質量の異なる同位体13Cが少し存在するが、平均相対質量(平均原子量)はほぼ12。
12Cを基準に各元素の相対質量(原子量)が決められて、
窒素原子 Nの原子量はほぼ14、
酸素原子 Oの原子量はほぼ16、
水素原子 Hの原子量はほぼ1。
分子の場合、分子量。
水分子 H2Oの分子量 2 + 16 = 18、
アンモニア分子 NH3の分子量 14 + 3 = 17、
二酸化炭素分子 CO2の分子量 12 + 32 = 44。
窒素原子(N)6.022×1023個で14[g(グラム)]、これが1[mol]。
酸素原子(O)6.022×1023個で16[g]、これが1[mol]。
水素原子(H)6.022×1023個で1[g]、これが1[mol]。
酸素や水素を基準に原子量を決めようとしたこともあったが、炭素 12C基準。
水分子(H2O)6.022×1023個で18[g]、これが1[mol]。
アンモニア分子(NH3)6.022×1023個で17[g]、これが1[mol]。
二酸化炭素分子(CO2)6.022×1023個で44[g]、これが1[mol]。
6.022×1023という数字は何なのだ---
6022垓(がい)
1020=1垓=1万京
0.62秭(し)
アボガドロ数(アボガドロ定数)という。
アボガドロはイタリアの化学者。
教科書などに肖像画が載っている
2018年、物質量は炭素 12C基準からアボガドロ定数基準に変わった。
ともかく
1[mol]の粒子数(原子数、分子数)は6.022×1023個
= アボガドロ定数 NA
1[mol]の原子・分子の質量は原子量・分子量
Mで表す
なので、
質量 m[g]の原子・分子の物質量 = (m/M)[mol]
N個の原子・分子の物質量 =(N/NA)[mol]
上の関係式は理解していないと
化学計算壊滅状態に陥りかねない。
粒子(原子・分子)1個の質量 m/Nは、
M/NA
・・・ m/M=N/NA
気体に関しては
気体は分子から成ると考えたアボガドロさんの
アボガドロの法則がある。
同圧、同温、同体積の気体は同数の分子を含む。
気体の種類によらない。
標準状態(0[℃]、1[気圧、atm]=1013[hPa])の下では、
22.4[l(リットル)]で6.022×1023個の分子を含む。
これが1[mol]。
体積 V[l]の気体[分子]の物質量 = (V/22.4)[mol]
mol -化学反応-
化学反応式の各項の係数は整数。
量的関係を表している。
2H2 + O2 → 2H2O
の場合、
2[mol]の水素と1[mol]の酸素が反応して、2[mol]の水が生成。
質量に注目すると
水素2[mol]で4[g]
酸素1[mol]で32[g]
水2[mol]で36[g]
4 + 32 = 36。
質量保存の法則。ラボアジエさん発見。「近代化学の父」。フランス革命の犠牲者。
2[mol]の水 H2O
2[mol]の酸素原子 O
4[mol]の水素原子 H
電池や電気分解の化学反応式にはイオンや電子が含まれるが、
イオンも電子も同じように扱える。
O2 + 2H2O + 4e– → 4OH–
の場合、
1[mol]の酸素と2[mol]の水と4[mol]の電子から4[mol]の水酸化物イオン。
電子 e–の質量は原子に比べて小さい。0ではないが、無視扱い。
イオンは電子が加わるか欠けるか。
32[g] + 36[g] = 68[g]。
電子込みでも質量保存。
質量は無視扱いだが、化学反応で流れる電気量は重要。
1[mol]あたり96500[C(クーロン)]。
ファラデー定数 F。
電子 e–の他、原子価1価のイオンも同じ値。
4[mol]だと38万6000[C]。
n[mol]だとn × 96500 = nF。
化学変化の量と流れる電気量は比例する。
ファラデーの法則。
流れる電気量が同じ場合、化学変化の量とグラム当量が比例する。
これもファラデーの法則。
グラム当量=[グラム]原子量/原子価。
※ equivalent eq
例えば、
酸素イオン O2-は2価の-イオンなので、
酸素のグラム当量は、16/2 = 8。
電子1個の電気量(=電気素量) eは、
e = 1.602 × 10-19[C]。
電子6.022×1023個(=アボガドロ定数 NA)の電気量は、
e × NA = 96500[C]。
= ファラデー定数 F。
これが1[mol]。
電気量 E[C]の電子の物質量 n = (E/96500)[mol]
= E/F